외상성 응고장애
Traumatic Coagulopathy
Article information
Abstract
Trauma patients often suffer from a “lethal triad” comprised of three entwined interacting components: hypothermia, acidosis, and coagulopathy. When the patients’ blood vessels are injured, hemostatic mechanisms are activated to heal the injured vessels and reduce blood loss. Yet when the injury is substantial, hemostasis becomes insufficient, and coagulopathy develops. The patients’ coagulation factors are exhausted, and bleeding is uncontrollable, a condition similar to disseminated intravascular coagulopathy (DIC). However, traumatic coagulopathy may differ from DIC in term of mechanisms. Unlike DIC, traumatic coagulopathy results from increased protein C activity inhibiting thrombin. Moreover, overt blood loss results in shock, mandating urgent resuscitation. However imprudent resuscitation with massive fluid and transfusion may induce hypothermia and acidosis, aggravating the coagulopathy. Recent studies recommend thromboelastogram to diagnose the complex status of coagulopathy and indicate the best treatment. Physicians treating trauma patients should address these intertwined, complex complications thoroughly and thoughtfully.
서론
외상은 전체 사망원인 중 약 10%를 차지하며, 특히 40세 이하의 젊은 연령대의 사망원인 중 1위를 차지하고 있다[1,2]. 이처럼 외상이 사망원인의 높은 빈도를 차지하는 이유 중 하나로 대량출혈이 큰 영향을 미치는 것으로 알려져 있는데, 실제 외상환자의 25∼35%에서는 응급실에 도착했을 때 이미 응고장애(coagulopathy)가 발생한 상태이며, 이로 인해 대량출혈이 악화되고, 결과적으로 다발성 장기 부전 및 높은 사망률을 나타내는 결과를 보이고 있다[3-5]. 응고장애는 저체온증(hypothermia), 산증(acidocis)과 함께 상호 인과 관계를 갖는 연결고리로 ‘죽음의 3 징후(lethal triad of death)’를 구성하고 있다(Fig. 1). 신속하고 정확한 치료를 통해 이러한 연결고리를 끊어주지 않는다면, 환자의 상태는 악순환에 빠지게 되고, 그 결과 사망에 이르게 된다.
따라서 이러한 응고장애를 동반한 외상환자를 진료하는 의료진은 응고장애의 기전에 대해 이해를 할 필요가 있으며[6], 이에 전세계적으로 외상에 의한 응고장애에 대한 많은 연구들이 진행되고 있고, acute traumatic coagulopathy, early coagulopathy of trauma, acute coagulopathy of trauma-shock, trauma-induced coagulopathy, trauma-associated coagulopathy 등과 같이 여러 표현들로 존재하며 외과계열(외과, 정형외과, 흉부외과, 신경외과)뿐만 아니라 마취과학회, 혈액학회, 중환자의학회, 응급의학회 등이 포함되어 다기관 및 다학제적인 측면에서 접근하고 있다. 이에 본 저자들은 외상성 응고장애의 기전에 대한 문헌고찰을 통하여 그 특성을 이해하고 아울러 외상환자 진료에 이바지하고자 한다.
본론
혈액응고과정
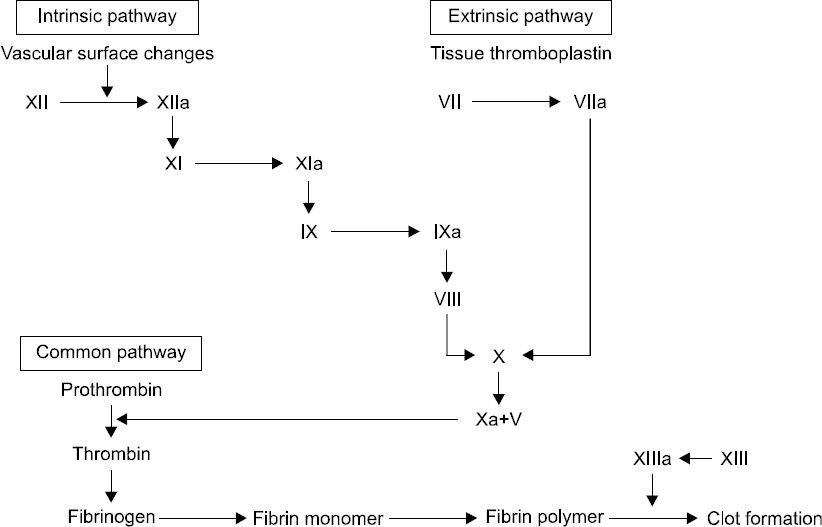
정상상태에서 신체는 응고(coagulation), 항응고(anticoagulation) 및 섬유융해(fibrinolysis)가 적절한 균형을 이루고 있으며, 응고는 여러 응고인자(factor)들의 다단계에 의해 형성된다(Fig. 2). 응고인자 XII, XI, IX, VIII 등이 관련되는 내인성 경로(intrinsic pathway)와 응고인자 III인 조직인자(tissue factor), 응고인자 VII 등이 관련되는 외인성 경로(extrinsic pathway)의 동시적인 작용에 의해 공통 경로(common pathway)에서 응고인자 X의 활성화, 그리고 응고인자 Va에 의해 응고인자 II인 프로트롬빈(prothrombin)을 응고인자 IIa, 트롬빈(thrombin)으로 활성화시킨다. 이 트롬빈은 응고인자 I이라고도 하는 섬유소원(fibrinogen)을 응고인자 Ia, 섬유소 단량체(fibrin monomer)로 활성화시키고 이는 응고인자 XIIIa, 섬유소 안정인자(fibrin stabilization factor)에 의해 섬유소 중합체(fibrin polymer)를 형성하게 된다. 칼슘(Ca++)은 응고인자 IV로 응고인자 XI, IX, X, VII 등의 활성화에 필요한 이온이다. 출혈이 발생하면 위와 같은 응고 단계가 활성화를 통해 섬유소 중합체와 손상 받은 혈관의 내피세포에 혈소판 응집이 생겨 혈전(clot)을 생성하여 손상된 부위가 임시적으로 막힌다. 혈소판의 겉면에는 당단백질(glycoprotein)이 있어 폰빌레브란트 인자(von Willebrand factor)에 의해 혈소판끼리, 그리고 손상된 내피세포에 응집을 유도한다. 또한 폰빌레브란트 인자는 평소 응고인자 VIII와 결합되어 있으며, 트롬빈의 작용에 의해 응고인자 VIII을 유리하고, 결합되어 있지 않은 응고인자 VIII은 분해가 된다.
섬유융해는 플라스미노겐 활성화 인자(plasminogen activator)에 의해 활성화된 플라시민(plasmin)에 의해 이루어지며, 융해가 된 물질을 섬유소원 분해산물(fibrinogen degradation products, FDP)이라고 부른다. 또한 응고인자 XIV라고도 불려지는 단백질 C (protein C)는 당단백질이며 단백질 S (protein S)를 보지인자(cofactor)로 트롬보모듈린(thrombomodulin)과 함께 활성화되었을 때는 응고인자 Va와 VIIIa를 비활성화시킨다.
이러한 응고인자들 이외에도 응고 및 항응고에 관련되는 물질에는 여러 가지가 있는데 비타민 K는 지용성 비타민으로 케일이나 시금치 같은 녹색잎 채소에 많이 함유되어 있고 혈액응고에 중요한 비타민이다. K는 응고의 독일어인 “Koagulation”의 앞 글자에서 나온 것으로, 비타민 K은 프로트롬빈 전구체(prothrombin precursor)인 응고인자 II 및 응고인자 VII, IX, X을 활성화시키는 데 필요한 탈 탄산효소(carboxylase)가 포함된 비타민 K epoxide 회로(cycle)의 주요 요소이다. 와파린은 이 회로 중 하나인 비타민 K 환원효소(expoxide reductase)를 방해하여 비타민 K의 응고기능을 막는다[7]. 항트롬빈(antithrombin) III는 세린 단백분해 억제효소(serin protease inhibitor) 중 하나로 헤파린과 결합하여 응고인자 XIa, IXa, 트롬빈 등의 작용을 방해한다.
파종성 혈관내 응고장애와 소모성 응고장애
파종성 혈관내 응고장애(disseminated intravascular coagulopathy, DIC)와 소모성 응고장애(consumptive coagulopathy)는 응고와 섬유융해의 균형이 무너진 상태이다. 전자는 감염, 종양, 출혈에 의해 다양한 크기의 혈전이 체내에서 대량으로 생성되고 이러한 혈전은 불필요한 곳에서 색전을 유발하는 상태이며, 후자는 응고인자들이 급격히 소모되어 혈전생성이 되지 않아 조절되지 않는 출혈이 발생하는 상태이다[8].
DIC가 경증인 상태에선 혈액검사에서 혈소판 감소, 프로트롬빈 시간(prothrombin time, PT) 연장, 활성화 부분트롬보플라스틴 시간(activated partial thromboplastin time, aPTT) 연장, 섬유소원 감소, FDP 증가, D-이합체(dimer) 증가 등의 이상소견이 발견되며, 이학적 검사에서 손가락 같은 말단 부위나 콩팥에서 색전에 의한 경색, 괴사가 일어날 수 있고, 출혈성 경향이 높아진 상태에선 피부에 출혈반이 나타나고, 뇌, 호흡기, 위장관 등에서 심각한 출혈이 발생할 수 있다. DIC는 섬유융해의 정도에 따라 3가지로 나눌 수 있다. (1) 섬유융해기기 억제된 상태(suppressed fibrinolysis)는 주로 패혈증에 의해 발생하고 색전에 의한 징후들이 보이며, (2) 섬유융해가 균등한 상태(balanced fibrinolysis)는 주로 종양에 의해 발생하고, 색전에 의한 징후와 출혈에 의한 징후가 같이 나타나게 된다. (3) 섬유융해가 심각한 상태(enhanced fibrinolysis)는 외상에 의한 출혈, 대동맥 박리, 급성전골수성 백혈병 등에 의해 나타나고, 심각한 출혈성 징후들을 보인다[9]. 혈액검사에서 섬유융해가 낮으면 플라스미노겐 활성화 인자 억제효소(plasminogen activator inhibitor)가 더욱 증가되게 되고 섬유융해가 높으면 D-이합체가 더욱 증가되게 된다.
DIC에서는 조직인자와 관련된 응고 단계가 활성화되며, 응고인자가 소모됨에 따른 징후들이 발생한다. 외상의 초기에는 섬유융해가 심각한 생태를 보여 출혈성 경향을 나타내다가 회복기에는 섬유융해가 억제된 상태를 보여 혈전성 경향으로 변한다고 할 수 있지만, 아직까지는 초기에 DIC의 소견을 보인다는 근거가 명확하지는 않다[10,11]. DIC만으로는 외상에서의 응고장애를 설명할 수 없기 때문에 educational initiative on critical care bleeding in trauma에서 외상성 응고장애에 대하여 새로 coagulopathy of trauma, acute coagulopathy of trauma shock라는 개념을 제시하였다[12,13].
새롭게 제시된 외상성 응고장애의 기전은 트롬보모듈린과 단백질 C가 활성화됨으로써 응고인자 Va와 VIIIa의 기능이 억제되어 발생하는 전신적인 항응고에 대한 반응으로 트롬빈 형성이 감소하여 출혈성 경향이 생기며, 활성화된 단백질 C는 플라스미노겐 활성화 인자 억제효소의 기능을 중화하여 섬유융해를 악화시킬 수 있다. 그리고, 외상성 응고장애에서는 트롬보모듈린 및 단백질 C의 기능이 중요한 반면 DIC처럼 조직 인자에 의한 트롬빈 형성 증가 및 응고인자의 소모가 없다는 특징이 있다[14-16].
외상성 응고장애의 기전에 대한 이론이 하나 더 있는데 신경호르몬 이론이다[16]. 외상이 발생하면 교감신경 부신수질계에 의해 카테콜아민이 분비되고 이것이 혈관내피 세포에 손상을 가하게 된다. 혈관내피 세포의 외벽에는 있는 당질피질(glycocalyx)이 손상되게 되며 이는 혈전 발생을 유도하게 된다. 이러한 혈전 반응이 전신적으로 오면 혈액순환에 장애가 올 수 있기 때문에 항상성을 유지하기 위해 트롬보모듈린에 의한 항응고 및 플라스미노겐 활성화 인자에 의한 섬유융해가 활성화된다. 심각한 외상환자에서는 이러한 작용들의 균형이 조절이 안되어 응고장애로 치우치게 된다[17].
이렇게 외상성 응고장애는 여러 기전이 있을 수 있고 하나만으로는 설명하기가 힘들다. 외상성 응고장애는 DIC와 비슷하게 여러 혈액검사에서 혈소판, 섬유소원, D-이합체, FDP 등이 유사한 결과를 나타내고, 외상성 응고장애만의 명확한 특징, 시간에 따른 경과, 예후가 아직 정립이 안되었기 때문에 아직까지는 섬유융해가 심각한 상태의 DIC와는 별개의 질병으로 보기는 어려운 현실이다[18]. 따라서 외상환자의 진료에 있어서는 이러한 응고장애의 개념을 이해하면서 저체온증 및 산증 같은 기타 위험한 요소를 포함한 포괄적인 접근이 필요하다.
혈액응고장애 원인
1) 저체온증과 응고장애
저체온증은 응고인자 VIIa 및 조직 인자의 기능 감소를 유발할 수 있으며 특히 손상된 조직에 혈소판에 있는 당단백질 Ib/IX가 응집을 유도하는 폰빌레브란트 인자의 기능을 저하시켜 응고장애를 발생시키는데, 환자의 체온이 33°C 이하이면 이러한 응고장애가 더욱 악화된다[19-21]. 외상이 발생하게 되면 환자는 여러 이유로 체온이 낮아지게 되는데 출혈 자체에 의해, 그리고 상처 부위에서 증발되는 열 손실에 의해 저체온증이 발생한다. 의식을 잃어 차가운 바닥에 오랜 시간 동안 누워 있게 되면 이 또한 추가적인 체온 손실이 발생하며 근육 운동에 의한 열 발생이 감소하게 된다. 또한 초기 소생술 중 하나인 수액치료가 저체온증을 유발할 수 있다.
2) 수액치료
외상환자의 환자에서 출혈이 발생하면 실혈량에 따라 여러 활력 징후들이 달라지게 되고 실혈량이 많을수록 저혈량성 쇼크가 오게 되며 이는 빨리 치료하지 않으면 다발성 장기 부전 및 사망을 야기할 수 있다. 이에 실혈을 대체할 수 있는 물질을 투입하게 되는데 가장 이상적인 물질은 혈액제제일 수 있다. 하지만 수혈은 안전한 투여를 위하여 사전에 교차적합성(crossmatch)을 확인해야 하고 준비된 혈액이 충분하지 않기 때문에 신속성이나 효율성이 떨어지는 측면이 있다. 그래서 저혈량성 쇼크의 위험이 있는 외상환자에서 초기 치료는 먼저 등장성 정질액(isotonic crystalloid solution)을 먼저 투여하고 그에 대한 반응을 보며 교차적합검사를 시행하여 수혈 준비를 하게 된다[22,23]. 이때 투여하는 등장성 정질액은 보통 생리식염수(0.9% saline)나 평형 염류용액(balanced salt saline)을 사용하게 되고 통상적으로 실혈 추정량의 3배 정도의 양을 투여 후 그 반응에 따라 추가 투여를 고려하게 된다. 출혈 환자의 초기치료에서 콜로이드 용액은 피하고 있는데 이는 콜로이드 제제에 함유된 전분(starch)이 폰빌레브란트 인자나 응고인자 VIII 등을 소모시켜 응고장애를 악화시킬 수 있기 때문이다[24,25]. 등장성 정질액 사용은 신속성 및 비용효율성 면에서 우수하지만 부작용이 존재한다.
대부분 수액제품들은 상온인 20∼25°C에서 보관되는데 이를 환자에게 대량 투여하게 될 경우 저체온증을 유발할 수 있다. 이는 실혈에 의해 이미 ‘죽음의 3 징후’에 빠져있는 환자의 응고장애를 악화시킬 수 있다. 또한 대량의 수액을 투여하면 희석효과에 의해 혈액의 산소운반 능력이 낮아지게 되고 혈소판 응집력 약화, 응고인자 희석, 혈전형성 장애를 유발하여 응고장애를 유발한다[19,22]. 특히 생리식염수 같은 경우 인간 혈장에 비해 나트륨 및 염소 농도가 높고 pH가 낮아 대량 투여 시 대사성 산증(metablic acidosis)을 유발하게 된다. 실혈량이 많은 사람에서는 산소공급이 부족해져 무산소적 대사가 이루어지며 이에 의해 유산(lactic acid) 및 케톤체(ketone body)가 유리되어 대사성 산증이 발생하는데 생리 식염수의 투여는 이를 더욱 악화시킬 수 있다. 산증은 ‘죽음의 3 징후’ 중 하나이며 혈장 단백 분해효소(plasma protease) 및 응고인자 Xa/Va 기능을 저하시켜 응고장애를 유발할 수 있다[19-21]. 이러한 생리식염수의 부작용을 완화하고자 개발된 수액이 평형 염류용액이다. 특히 플라스마솔루션(plasma solution)이나 플라스마라이트(plasmalyte) 같은 경우 인간 혈장 구성과 그 구성이 제일 비슷하여 산증 위험성이 적고 나트륨 및 염소의 과다 투여를 막을 수 있다. 한 코호트 연구에서 생리식염수와 평형 염류용액을 각각 투여한 군을 비교한 결과 평형 염류용액 군에서 수술 후 감염, 신장투석, 수혈 그리고 산증 같은 합병증이 통계적으로 유의하게 낮게 나왔다고 발표하였다[25]. 또한 Young 등[26]이 시행한 생리식염수와 플라즈마라이트를 외상환자에게 투여하여 비교한 이중맹검, 무선 할당 통제 연구(double blind, randomized controlled trial) 결과 플라즈마라이트를 투여한 군이 식염수를 투여한 군보다 산염기 상태가 좋았으며 고염소혈증이 낮았다고 보고하여 외상환자에서 플라즈마라이트 같은 평형 염류용액 사용에 대해 더욱 고려하고 연구할 필요가 있다.
이러한 수액 투여의 부작용을 최소화 하기 위해 온장고에 보관한 수액 투여, 수액 가열기 사용, 평형 염류용액 사용 등을 고려하여 응고장애를 포함한 ‘죽음의 3 징후’ 악화를 최소화시킬 필요가 있으며 수액제제가 대량 투여가 필요할 정도의 환자에서는 반드시 수혈을 고려하여 한다.
3) 수혈
외상을 포함한 모든 출혈에 의한 허혈 환자에서는 가장 이상적인 수혈은 전혈(whole blood) 수혈이다[27-29]. 하지만 전혈은 장기간 보관이 어렵고 각각 상황에 맞게 투여하기 위해 대부분 헌혈된 혈액은 분리를 하여 성분에 따라 보관하게 된다. 그 중 대표적인 것으로 적혈구(red cell), 신선동결혈장(fresh frozen plasma), 농축 혈소판(platelet concentrate) 등이 있으며 저온 침강물(cryoprecipitate) 같은 응고인자 제제도 있다. 이 중 헤모글로빈이 포함된 적혈구는 산소운반에 있어 중요한 혈액 제제이며, 보관시 응고가 될 수 있기 때문에 구연산(citrate)을 첨가하여 혈액 내 칼슘과 반응하여 응고를 방지하지만, 실혈량이 많아 대량 수혈을 하게 되는 환자에서는 응고장애를 유발하게 된다. 또한 적혈구가 2주 이상 보관될 경우 칼슘이 킬레이트화(chelation) 됨으로써 저칼슘증 상태로 변하게 되어 이런 적혈구는 투여할 경우에도 응고장애를 유발할 수 있다.
이러한 부작용 때문에 대량 수혈이 필요한 환자들의 치료에 있어서는 대량수혈 진료지침(massive transfusion protocol)과 같은 정량화된 시스템을 통해 효율적이면서도 환자에게 적합한 치료를 해줄 필요가 있다[30]. 대량 수혈에 의한 부작용을 최소화하려면 수혈량을 최소화하여야 되는데 이에 가장 중요한 것은 가급적 빠른 수술, 시술을 통해 추가적 출혈을 막는 것이다. 또한 적절한 헤모글로빈 수치를 목표로 하여 수혈량을 조절하고 트라넥사민산(tranexamic acid) 같은 혈액응고제를 사용을 고려하여야 한다[31]. 뿐만 아니라, 적혈구 수집기(cell salvage)를 이용하여 자가수혈을 하거나 가족에게 헌혈을 받아 전혈 수혈을 고려할 수 있고 전혈 수혈에 가까운 성분별 동시 수혈도 고려할 수 있다. 미군 연구에서는 pRBC:FFP:platelet 비율을 1:1:1로 권유하고 있으며 가정 적절한 비율을 위해 여러 연구들이 나오고 있다. Pragmatic, randomized optimal platelet plasma ratios 연구에서는 이 비율을 1:1:1군과 2:1:1군으로 나누어 비교하였고 두 군 간 장기적 사망률이나 합병증 발생률은 통계적 차이가 없으나 단기간 사망률(24시간 내, 30일 내)은 1:1:1이 낮다고 보고하였다[32]. 수혈을 할 때는 적혈구 외에도 여러 성분 수혈을 고려하여 투여하여야 하며 환자의 응고장애 상태에 따라 조절할 수 있다. 응고장애를 정도를 판단하는 데에는 혈전탄성묘사도(thromboelastograph, TEG)를 이용할 수 있다.
치료
출혈이 있는 환자의 상태를 파악하기 위해 여러 가지 혈액검사를 시행하는데 일반혈액검사(complete blood count)를 통한 헤모글로빈, 혈소판 수치로 환자의 실혈 정도를 판단하고, 혈액 응고장애의 유무 및 그 정도를 판단하기 위해 PT, aPTT, 활성혈액응고시간(activated clotting time) 등을 이용한다. 하지만, 환자가 기저질환을 가지고 있거나 아스피린이나 와파린 같은 항응고약물을 복용 중이었다면 그 수치들의 기준(baseline)을 잡는 데 애매할 수 있다. 이러한 기왕력이 없는 환자에서는 일반적으로 PT는 정상수치를 12∼15초(international normalized ratio, 0.8∼1.2), aPTT는 30∼50초를 기준으로 하여 그 이상이면 응고장애로 진단하게 된다. 하지만 이러한 기존 검사들은 민감도 또는 특이도가 낮을 뿐더러 결과가 나오는 데 30분에서 한 시간 이상이 필요하기 때문에 정확하고 즉각적인 치료가 어려울 수 있다. 이에 최근 TEG의 사용이 고려되고 있다. 이 검사는 1948년 Hartert에 의해 고안된 오래된 방법이나 결과가 나오기까지 5∼10분 정도 소요되기 때문에 환자에 응고장애에 신속하게 대응할 수 있어 최근에 많은 의료진들이 이 검사의 활용을 고려하고 있다[33-37]. 특히 1:1:1 수혈을 하게 되면 혈액제제 사용이 증가할 수 있는데 이 검사를 활용하여 그 수량을 최소화할 수 있다. 이 검사를 통해 혈전 형성의 시간과 응고력, 융해 등을 알 수 있으며(Fig. 3), 여러 응고장애 상황을 한눈에 알아볼 수 있다(Fig. 4). 또한 이 검사는 수혈 중에 수시로 시행하여 상황에 맞게 성분 수혈 등의 대처를 할 수 있다(Table 1).
결론
아직까지는 외상성 응고장애의 기전에 대하여 명확한 구분이 이루어지지 않은 것이 현실이지만, 외상성 응고장애로 인한 출혈이 외상에 의한 주된 사망원인이라는 점은 변치 않는 사실이다. 따라서 출혈에 의한 저혈량성 쇼크가 의심되는 환자에서는 외상성 응고장애를 악화시킬 수 있는 저체온증을 적극적으로 예방하고, 가온된 적절한 수액을 소생술에 이용할 뿐만 아니라, 전혈 수혈이 가능한 상황이 아니라면 효과적인 성분 수혈을 위하여 TEG와 같은 최근에 각광받는 장비의 사용을 고려할 수 있다.