외상으로 인한 진행성 출혈이 동반된 와파린 복용 환자에서의 새로운 경구 항응고제의 적용
Adaptation of New Oral Anticoagulants for Warfarin Anticoagulated Patient with Traumatic Ongoing Hemorrhage
Article information
Abstract
The traditional drug for anticoagulation in those with a high risk of thrombosis is a vitamin K antagonist, such as warfarin. On the other hand, this drug has several limitations and hemorrhagic complications. Recently, novel or non-vitamin K-dependent antagonist oral anticoagulants (NOACs) have been developed to solve these problems. This paper presents a case of adaptation of NOAC for a warfarin anticoagulated patient with traumatic ongoing hemorrhages with a discussion of the clinical implications of NOAC.
서론
심방세동, 인공판막치환술 등 색전증을 야기할 수 있는 고위험군의 환자에서는 예방적 항응고 요법 목적으로 현재까지 가장 널리 사용되던 약제는 비타민 K 길항제인 와파린(warfarin)이다. 그러나 약동학적인 불안정성으로 치료 효과를 나타내는 범위가 적은 단점이 있고, 그로 인한 부작용으로 출혈성 합병증이 흔히 보고되고 있는 것이 현실이며, 출혈성 합병증이 의심되는 경우에는 항응고제를 중단하고 심한 경우 신선냉동혈장이나 비타민 K를 투여하며 응고 이상을 교정해야 할 필요성이 있다. 최근에는 이런 항응고제를 대체할 수 있는 약제로 새로운 경구 항응고제(novel or non-vitamin K-dependent antagonist oral anticoagulant, NOAC)가 개발되었으며, 혈액검사를 통한 모니터링이 없이 색전증이 발생할 수 있는 고위험군의 환자를 대상으로 혈전색전등의 예방을 위해 많이 사용되는 등 그 효과가 각광을 받고 있다.
저자들은 와파린을 복용하던 환자에서 외상 후 진행성 출혈이 관찰되어 혈관조영술을 통한 색전술을 시행하여 지혈을 유도한 후 혈전색전증의 예방을 위해 NOAC을 적용한 증례를 보고하며 NOAC에 관한 최신 문헌을 고찰하고자 한다.
증례
82세 남자 환자가 내원 7일 전 실내에서 넘어지면서 우측 옆구리를 부딪힌 후 발생한 우측 옆구리의 통증 및 종괴로 타박상 의증 하에 인근 병원에서 입원치료를 시행하던 중, 내원 2일 전부터 우측 옆구리의 통증이 악화되고 종괴의 크기가 증가되어 혈액검사 및 복부 단층촬영을 시행하였으며, 혈색소 수치 5 g/dl 및 복부 단층촬영상 복벽 및 후복막강 혈종이 의심되어 농축적혈구(packed red cell) 5 units을 수혈하며 본원으로 전원되었다. 환자는 과거력상 고혈압 및 심방세동으로 약물 복용을 하던 중 10년 전 뇌졸중이 발생하였으며, 6년 전부터 심부정맥 혈전증, 폐동맥 색전증이 동반되어 와파린 7.5 mg/day를 복용하였다.
본원 내원 당시 환자의 Glasgow coma scale은 15점이었으며, 활력징후는 혈압 147/76 mmHg, 맥박 114회/분, 호흡수 20회/분, 체온 36.8°C였다. 이학적 검사상 우측 옆구리에서 15×10 cm 크기의 반상출혈을 동반한 종괴에서 압통 및 열감이 관찰되었으나, 그 외 복부에서 복막 자극증상은 관찰되지 않았다. 본원에 내원하여 시행한 일반혈액검사상 백혈구 수치는 21,400/mm3, 혈색소 수치는 6.0 g/dl, 혈소판 수치는 225,000/mm3였으며, 혈액응고검사상 프로트롬빈 시간(prothrombin time, PT; %)은 2.4%, 국제표준화비율(international normalized ratio, INR)이 13.09, activated partial thromboplastin time은 117.4초였다.
본원에서 시행한 복부 단층촬영상 우측 복벽 및 요근, 장요근의 혈종에서 조영제의 활동성 유출을 동반되어있었으며(Fig. 1), 혈관조영술을 통한 색전술을 시행하였다(Fig. 2-4).
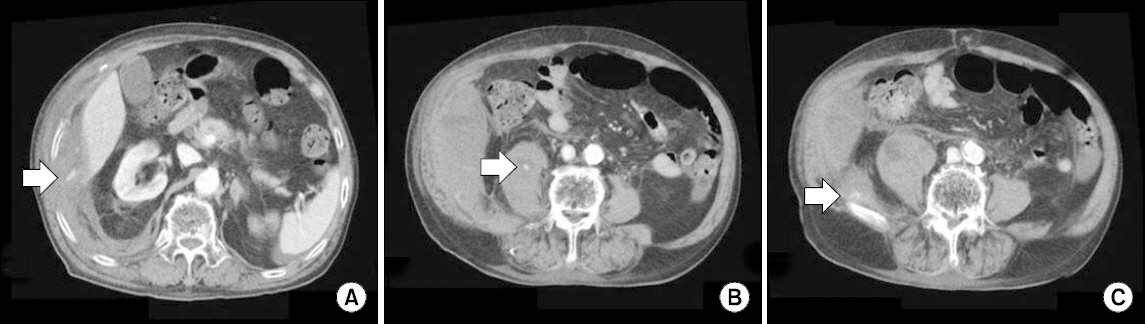
Initial computed tomography (CT) findings showing extravasation (white arrows). (A) Abdominal wall hematoma, (B) intramuscular hematoma of psoas muscle, (C) intramuscular hematoma of ilio-psoas muscle.
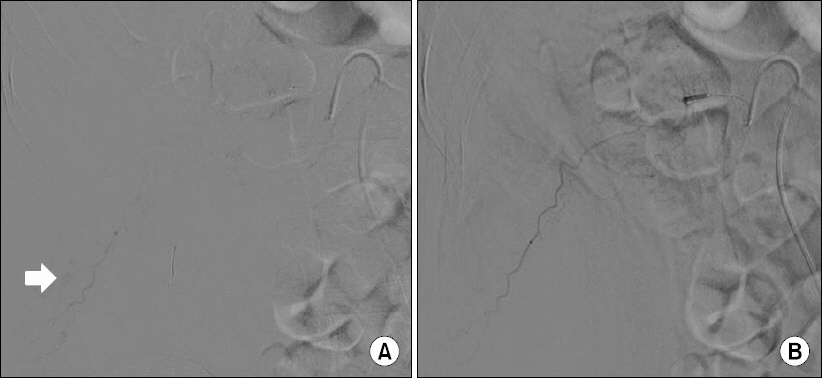
Angiography for intramuscular hematoma of ilio-psoas muscle. (A) Pre-embolization showing extravasation (white arrow), (B) post-embolization showing no extravasation

Angiography for abdomial wall hematoma. (A) Pre-embolization showing extravasation (white arrow), (B) post-embolization showing no extravasation.
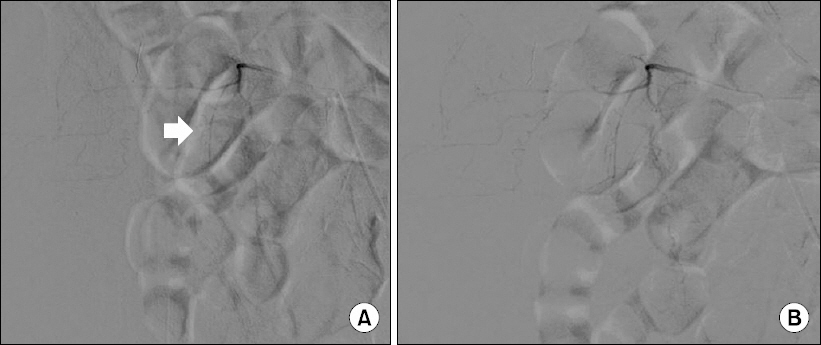
Angiography for intramuscular hematoma of psoas muscle. (A) Pre- embolization showing extravasation (white arrow), (B) post-embolization showing no extravasation
시술 후 기존 항응고 요법을 중지하고, 신선 동결 혈장과 비타민 K를 보충하며 INR을 교정하였다. 이후 우측 옆구리의 통증은 점차 호전되는 양상을 보였으며, 내원 7일 후부터 enoxaparin 40 mg/day로 예방적 항응고 요법을 시행하였고, 기존 폐동맥 심부정맥 혈전증 선별검사를 목적으로 흉부 단층촬영을 시행하였고. 검사결과 양측 심부정맥의 혈전이 관찰되었다. 내원 10일 후 NOAC (edoxaban, 2.5 mg qd, [once daily])로 항응고 요법을 교체하였으며, 내원 13일 후 퇴원하여 현재는 외래에서 특별한 혈전색전증의 후유증 없이 추적관찰 중이다.
고찰
혈관색전증의 고위험군 환자들에게 있어서 경구용 항응고제는 일상 생활 중 장기적으로 복용하여야 하는 약물이다. 기존의 비타민 K 길항제는 간에서 합성된 이후, vitamin K conversion cycle을 통하여 카르복실화(carboxylation)되어 활성화되는 혈액응고인자 II, VII, IX, X, protein C, protein S에서 vitamin K conversion cycle을 경쟁적으로 억제한다. 이들 인자의 불활성화를 통하여 혈액응고인자 II, VII, IX, X이 관여하는 혈액응고과정(coagulation cascade)의 내인성 및 외인성 경로(intrinsic and extrinsic pathway)를 억제하는 약제이다[1].
비타민 K 길항제는 비타민 K 섭취, 간에서의 약물 대사, 유전적 영향 등 다양한 상호작용이 존재하여, 임상에서 여러 가지 제한점을 가지게 된다. 첫째, 약물의 작용이 나타날 때까지 걸리는 시간이 길어, 빠른 시간 내에 항응고효과를 보는 것이 필요한 환자는 헤파린(heparin)과 같은 약제를 가교 치료(bridging therapy)로 사용해야 하며. 반감기가 길어 수술 또는 시술 전에 수일간 복용을 중지하고 PT가 낮아졌는지 측정해야 하는 불편이 있다. 둘째, 항응고 요법이 필요한 환자의 경우 심혈관계 질환을 가지고 있는 경우가 많이 있는데 와파린은 cytochrome P450 (CYP) 2C9에 의해 부분적으로 대사되기 때문에 대표적인 억제자인 아미오다론(amiodarone)이 와파린과 같이 처방되는 경우에는 와파린의 용량 조절에 주의가 필요하다. 셋째, 약물 대사와 관련된 CYP 2C9과 비타민 K 대사에 관련된 VKORC1 유전자의 다형성으로 개인별 와파린 용량의 차이도 발생하는 경우도 있다. 넷째, 치료 효과가 나타나는 영역이 좁아 잦은 모니터링이 필요하며, 끝으로, 다양한 식품들이 대사나 작용에 영향을 미치므로 주의를 요구한다.
이러한 제한점은 혈관색전증의 합병증으로 인해 뇌졸중의 과거력이 있거나, 대부분의 환자군이 고령임을 감안하였을 때, 치료의 순응도를 떨어뜨리는 원인이라 할 수 있으며, 그로 인해 출혈이라는 심각한 합병증을 유발하기도 한다. 항응고 요법을 시행 받은 환자는 항응고 요법을 받지 않는 환자에 비해 출혈성 합병증이 발생한 위험도가 5배 더 높은 것으로 보고되고 있으며, 출혈성 합병증이 발생하는 부위도 두경부 내 출혈, 소화기 계통의 출혈, 후복막강 출혈 등으로 다양하게 보고되고 있다[2,3]. 본 증례에서는 발작성 심방세동 및 폐동맥 색전증의 과거력이 있는 자가 고용량의 와파린을 복용하고 있었으나, 치료 순응도가 떨어지는 상기 원인들로 인하여 경미한 외상에도 활동성 출혈이 동반된 다발성 혈종이 발생하였다.
이에 최근에는 비타민 K 길항제에 비하여 고위험 뇌졸증 환자에게서 사용하기 훨씬 쉽고 안전한 약물로 NOAC을 권고하고 있다. 북미와 유럽의 심장학회 가이드라인 의하면 비판막상 심장질환자에서 심방세동이 있을 경우 항응고 요법의 대상이 되는 환자들은 와파린과 NOAC을 사용할 수 있다고 권고하고 있고, 유럽학회는 NOAC을 임상적 판단 하에 와파린보다 우선해서 사용하는 것에 대한 경우를 권고강도 IIa, 증거수준 A로 권하고 있다[4-6].
NOAC 작용기전은 혈액응고과정의 최종 공통 경로인 응고인자 X이 활성화(activated factor X, factor Xa)되어 응고인자 II인 프로트롬빈을 트롬빈(thrombin)으로 활성화시키는 과정를 직접 억제하는 것으로(Fig. 5), 최근 직접적 트롬빈 억제제인 dabigatran과 직접적인 응고인자 Xa 억제제인 rivaroxaban, apixaban, edoxaban 등이 개발되었다[1,7,8]
이들 약물은 예측 가능한 약역동학을 보이므로 혈액검사를 통하여 혈중농도를 확인할 필요가 없으며 투여 후 빠른 작용을 보이며 약을 끊으면 비교적 빠른 시간 내에 약물 효과가 사라지고. 다른 약물이나 음식과의 상호작용이 거의 없어서 기존의 비타민 K 길항제의 제한점을 많이 보안하였다고 볼 수 있겠다.
NOAC의 경우 비교적 약동학적으로 안정적이지만 신장으로 주로 배설되기 때문에, 중등도의 P‐glycoprotein 억제제인 아미오다론, 베라파밀(verapamil), 퀴니딘(quinidine), 에리트로마이신(erythromycin), 클래리트로마이신(clarithromycin) 등과 동시 처방을 할 경우, 75∼80세 이상의 고령, 60 kg 이하의 저체중, 크레아티닌 청소율(creatinine clearance, Ccr) 30∼50 ml/min의 중등도 신기능 저하 환자에서는 용량을 감량하여야 하며, 아직까지 아스피린(aspirin)이나 클로피도그렐(clopidogrel)과 같은 항혈소판제를 같이 사용하는 경우에 연구 데이터가 부족하여 마찬가지로 용량을 감량하여야 한다. 또한 강력한 P‐glycoprotein 억제제인 human immunodeficiency virus protease 억제제(리토나비르, ritonavir), 경구용 케토코나졸(ketoconazole)을 포함한 아졸계 항진균제(이트라코나졸[itraconazole], 보리코나졸[voriconazole], 포사코나졸[posaconazole])를 사용 중인 환자이거나 Ccr 30 ml/min 혹은 혈청 크레아티닌 농도(serum creatinine, Cr) 1.5 mg/dl 미만인 신기능 저하 환자의 경우 금기증에 속한다[9].
또한 주의를 요하지 않는 환자에게 있어서 약물의 조절은 대개 필요하지 않지만 NOAC을 복용하는 모든 환자는 매년 혈액검사를 통한 신기능의 추적관찰이 필요하며 Ccr 30∼49 ml/min의 신기능 저하자에게 사용시는 일년에 2∼3회 정도 신기능의 추적관찰을 하는 것을 권고하고 있다[6].
임상에서 기존의 경구용 항응고제인 와파린을 복용하다가 NOAC으로 변경하는 경우에는 PT를 측정하여 INR이 2.0 미만이 되면 NOAC을 복용하기 시작하며, 복용 이후 2일 이내에는 PT가 거짓으로 상승되는 경우가 있어 검사결과를 해석하는 데 주의를 요하겠다. 저분자량헤파린을 투여 받던 환자는 다음 번 투여 예정시간 0∼2시간 전에 NOAC을 투여하고 저분자량헤파린을 끊는다.
출혈의 위험성이 큰 수술이나 주요 장기의 수술의 경우에는 3일 전에 NOAC을 중단하고 중등도의 출혈위험성이 있는 수술의 경우에는 48시간 전에 중단한다. 신기능이 저하된 환자에서는 약물의 배설이 느리므로 조금 더 일찍 NOAC을 중단하는 것이 좋다 수술 이후에는 출혈가능성이 높은 큰 수술이나 주요 장기의 수술의 경우 48시간 이후 복용을 시작하며 출혈 위험성이 적은 수술의 경우에는 24시간 이후 복용을 시작한다[10]. NOAC을 사용하는 환자에게서 출혈이 발생하였을 경우 dabigatran의 경우 idarucizumab (Boehringer Ingelheim Pharma GmbH & Go. KG, Biberach an der Riss, Germany)이라는 길항제가 개발되었으나 국내에서는 아직까지 사용할 수 없으며 NOAC의 반감기가 짧아 특별한 중재술 없이 단시간 내 지혈되는 경우가 많다.
NOAC은 약물 및 음식과의 상호작용은 기존의 와파린에 비해 매우 적으나 와파린과 비교하여 뇌졸중의 예방 효과는 비슷하거나 더욱 효과적인 것으로 보고되고 있어, 기존의 불편한 약물 복용으로 고통 받는 의료진과 환자들에게 NOAC는 간편한 복용법을 장점으로 널리 사용될 것으로 기대된다.
국내에서는 보험기준은 dabigatran의 경우, 1) 비판막성 심방세동 환자 중에서 뇌졸증, 일과성 허혈발작, 혈전색전증의 과거력이 있거나 75세 이상 환자 또는 2) 6가지 위험인자(심부전, 고혈압, 당뇨, 혈관성 질환, 65∼74세, 여성) 중 2가지 이상의 조건을 가지고 있는 고위험군 환자에서 와파린을 사용할 수 없는 경우(와파린에 과민반응, 금기, INR 조절 실패 등)에 소견서를 첨부한 경우로 인정하고 있으며, rivaroxaban, apixaban, edoxaban의 경우는 심재성 정맥 혈전증, 폐 색전증의 치료 및 재발 위험의 감소를 위한 경우까지 보험 급여 기준이 확대되어 인정되고 있다. 비록 국내에서 보험기준이 제시되어 사용되고 있지만 아직까지 아시아인을 대상으로 한 데이터가 많이 부족한 상태로 향후 임상의들은 이들 약물의 사용 시에 발생할 수 있는 부작용 혹은 치료 효과 등에 관련한 세심한 관찰이 필요하겠다. 본 증례에서는 심방세동 환자에서 뇌줄증 위험도를 평가하기 위한 CHADS2 점수에서 4점으로 지속적인 항응고 요법이 필요한 환자로, 보험기준 중 비판막성 심방세동 환자에서 뇌졸중의 과거력이 동반되고, 75세 이상으로 와파린 사용중 INR 조절 실패로 인한 출혈성 경향을 보인 상태에서 폐 색전증의 재발 위험을 감소를 위하여 edoxaban을 사용하기로 결정하였다.
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
